
東京理科大学 教授
大江 修造

日本ブチル(株)殿
2.気液平衡とは
計算例
3.気液平衡の計算方法
気液平衡の計算(1) 平衡係数(平衡比)
気液平衡の計算(2) 相対揮発度
気液平衡の計算(3) ラウールの法則
気液平衡の計算(4) 活量係数
気液平衡の計算(5) 状態方程式
気液平衡とは混合液(溶液)の蒸気圧のことです。
液体の蒸気圧や塩の溶解度は、「相平衡」と言います。相平衡とは、気体、液体、固体が2つ以上存在しているときのことをいいます。平衡とはつり合っているということです。そういう意味で、蒸気圧とは気体と液体の温度と圧力がつり合っていること、すなわち同じであることから「相平衡」といえます。
気体と液体が平衡であるという意味で、蒸気圧も気液平衡であるといえますが、専門分野で蒸気圧のことは気液平衡とは言いません。飽和蒸気圧という語もありますが、蒸気圧は、もともと飽和状態のことを示していますから、飽和蒸気圧という語もほとんど使われません。
この点が、蒸気圧や気液平衡を初めて学習する高校生には分かりにくい点と言えます。ちなみに、昭和47年発行の教科書「新訂化学B」、東京書籍株式会社発行には、気液平衡という語は記載されていませんでした。
そこで、先ず「蒸気圧とは何か?」について考えます。この答を我々は身近に体験できます。ビーカーに 水を入れて放置しておくと、ビーカーの中の水は無くなります。これは、 水が空気中に蒸発したからです。では、なぜ、水は蒸発するのでしょうか?
それは、液体である水の分子が運動しているからです。
 |
→ |
 |
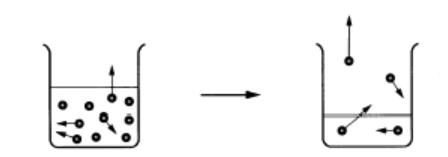

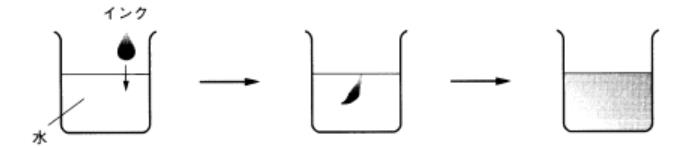
図3 水にインクをたらすと色がうすくなるのは
水の分子がインクをちらばすから
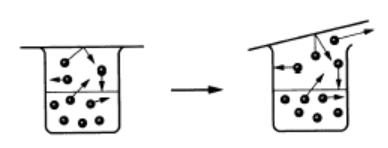
図4 水の分子がフタに当り圧力となる
→「蒸気圧」
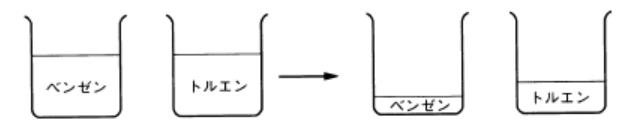
図5 ベンゼンの方が先に蒸発する
その理由はベンゼンの方がトルエンより蒸気圧が大きいからです。ベンゼンの方が、分子の運動が激しいのです。そのために、トルエンより 余計に蒸発します。すなわち、ベンゼンとトルエンの蒸気圧には差があるのです。
ベンゼンとトルエンを混ぜたらどうなるでしょうか?すなわち、気液平衡とは何かを考えます。 混ぜた場合でもベンゼンの方が余計に蒸発します。混ぜてもベンゼンの蒸気圧の方が大きいことに変わりはないのです。
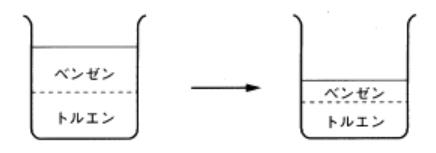
ベンゼンが多く蒸発する
ビーカーにフタをしますと、蒸発したベンゼンやトルエンには逃げ場はありません。ビーカーの中に止まります。その結果、気体はベンゼンの濃いものとなります。図7を見て下さい。液体と気体のベンゼンとトルエンの濃度を示しました。液体中にはベンゼンとトルエンが同じ量入っているものとします。気体(蒸気)になると、ベンゼンの濃度が高くなっています。なぜなら、ベンゼンの蒸気圧の方がトルエンより大きいからです。
これが、混合物の蒸気圧、すなわち、気液平衡です。 気液平衡とは、気相と液相とが平衡(つり合う)にあるという意味ですが、これは、図7にあるように、気相の濃度と液相の濃度がつり合っているという意味なのです。
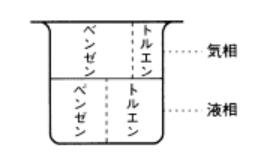
図7 気相はベンゼンの濃い蒸気が得られる
(気体のことを気相、液体のことを 液相と言います)
→「気液平衡」
にベンゼンの濃度が高いベンゼンとトルエンの混合物の気相を得ることができます。この蒸発、凝縮、蒸発・・・という繰り返しが蒸留の原理となります。
蒸留を実現するためには、蒸留する溶液の気液平衡が必要不可欠です。ここに、気液平衡を学ぶ意味があるのです。
気液平衡の計算例を以下に示します。
ベンゼンとトルエンが等モル存在するときの気液平衡を計算します。
液相のベンゼンおよびトルエンのモル分率は、それぞれ0.5となります。
今、40℃の場合を考えますと
ベンゼンの蒸気圧の測定値は25.0 kPa, トルエンの蒸気圧の測定値は7.89 kPaですから、ラウールの法則により
ベンゼンの気相における分圧は、25.0×0.5=12.5(kPa)
トルエンの気相における分圧は、7.89×0.5= 4.0(kPa)
となります。
したがって、全圧はドルトンの法則により、12.5+4.0=16.5 (kPa) ですから、
ベンゼンの気相におけるモル分率は、12.5÷16.5=0.76(モル分率)
トルエンの気相におけるモル分率は、4.0÷16.5=0.24(モル分率)
がえられます。
すなわち、液相にはベンゼンとトルエンは1対1で存在しているのに、
気相ではベンゼンとトルエンは約3対1で存在しているのです。
図7は、この液相と気相の濃度の関係を、模式的に示しています。
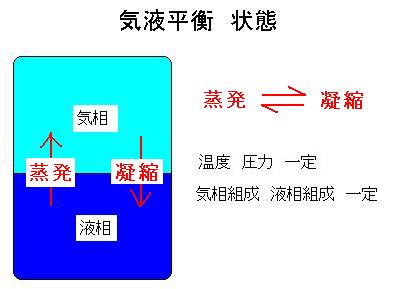
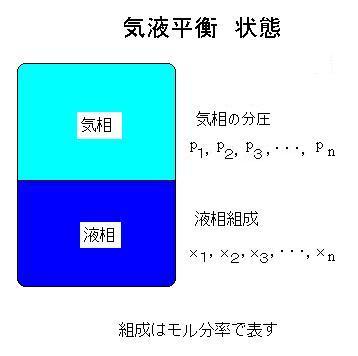
蒸留塔の設計には気液平衡の計算が必要です.この気液平衡を原理図により分かりやすく解説します。密閉した容器中に溶液を入れた状態で、温度、圧力、気相と液相の各組成が変わらない状態を気液平衡状態と言います。図を参照してください.
これは液相から気相への蒸発と気相から液相への凝縮とが平衡になった状態です.蒸発・凝縮の際,通常の気液平衡では成分同士は反応しません.反応をする場合は「反応を伴う気液平衡」と言って区別します.揮発成分同士の気液間の平衡を気液平衡と言い,固体成分を含む平衡(蒸気圧降下や沸点上昇)は気液平衡とは言わずに固液平衡と言います.
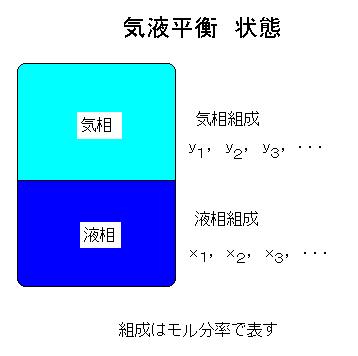
温度、圧力、気相と液相間の関係を図で示すのが気液平衡曲線あるいは相図と言います.また気相と液相間の関係を図で示すのがx-y曲線で,主に化学工学で使います.参考:気液平衡データ
気液平衡の計算はラウールの法則や活量係数を用いて行います.ラウールの法則を用いることができる理想溶液の場合は蒸気圧データのみから計算すなわち推算できます.活量係数を用いる非理想溶液の場合は実験により得たデータから相関します.
y2=K2x2
y3=K3x3
.....
yn=Knxn
ここに, K1,K2,K3,....Knを平衡係数あるいは平衡比と言います。1,2,3,....,nはそれぞれ第1成分,第1成分,第2成分,第3成分,,..,第n成分を示します。
y2=α2x2/(α1x1+α2x2+α3x3+...+αnxn)
y3=α3x3/(α1x1+α2x2+α3x3+...+αnxn)
.....
ここに, α1,α2,α3,....を相対揮発度と言い、
それぞれ,P1/Pn,P2/Pn,P3/Pn,....,Pn/Pnであり、P1,P2,P3,..,Pnは、それぞれ各成分が単独で存在するときの蒸気圧です。
ラウールの法則による計算
p2=P2x2
p3=P3x3
.....
pn=Pnxn
ここに, p1,p2,p3,....,pnを各成分の分圧と言います。
P1,P2,P3,..,Pnは、それぞれ各成分が単独で存在するときの蒸気圧です。このように気液平衡を表現できるのは理想溶液の場合です。蒸気圧はアントワン式により計算します.
p1=P1γ1x1
p2=P2γ2x2
p3=P3γ3x3
.....
pn=Pnγnxn
ここに,P1,P2,P3,..,Pnは、それぞれ各成分が単独で存在するときの蒸気圧である。p1,p2,p3,....,pnを各成分の分圧と言います。γ1,γ2,γ3,....,γnをそれぞれ各成分の活量係数と言い、非理想溶液の気液平衡を表現するための熱力学的に定義される係数です。ラウールの法則を活量係数で補正した表現です.活量係数はウィルソン式により計算します.
本サイトの運営者・大江修造のプロフィル |
1. 本サイトの運営者・大江修造の主要な研究実績 |
|
〇工学博士 |
|
東京都立大学院、1971年授与、指導教授は、気液平衡研究の第一人者であった故平田光穂教授、学位論文名「蒸留プロセスおよび蒸留塔の設計に必要な気液平衡の研究」 IHI㈱主任研究員を経て、東海大学教授、東京理科大学教授を歴任。この間、米国の蒸留研究機関FRI (Fractionation Research, Inc .)の客員研究員を経てコンサルタントに従事。 |
| 〇気液平衡データ集 |
|
1975年上梓の気液平衡データ集(主要著書1番)は、ウィルソン式定数を世界で初めて掲載し、DECHEMA(ドイツ)のデータ集より2年早く出版され,MITのReid教授の書評で極めて高く評価された。マチューセッツ工科大学の物性推算法の第一人者であるReid教授は世界で最も権威がある米国の化学工学学術論文誌の最終頁の書評欄で「最も印象的で美しい気液平衡データ集...」と評価していただいた。 この書評のためもあって、同著は多くの化学工学技術者に親しまれた。Reid教授が他の共同執筆者とともに執筆した名著(初版)の3版以後、役に立つデータ集として、(主要著書2,3,4番)とともに紹介されている。 |
|
〇大江モデル |
|
気液平衡における塩効果の推算法として提案した溶媒和数を使う推算法は、米国化学会の招待講演で発表後、「大江モデル」として使われている。 招待講演は米国化学会の専門書 Advances in Chemistry Series に2回収録されている。Prediction of Salt Effect on Vapor-Liquid Equilibrium: A Method Based on
Solvation 多数の引用例があるが、2例のみを示す。ジョージア工科大学のTejaによる大江モデル論文の引用が学術論文誌 Fluid Phase Equilibria, 219 (2004) 257-264に掲載されている。同様にウィスコンシン大学のPabloらによる引用が米国化学会の学術誌 Ind. Eng. Chem. Res. 1996, 35, 234-240に掲載されている。 |
|
〇アングルトレイの発明 |
|
運営者が発明し、勤務先IHI(株)で社長賞を得たアングルトレイを、米国の蒸留研究機関FRIで、客員研究員として実証試験を行った。圧力損失が小さく、高効率である性能を有し、化学会社10社以上で採用された。 研究開発の成果は以下の「石川島播磨技報」に発表した。 米国のFRIでの試験の結果、アングルトレイの性能が優れていることが分かったので、米国の化学工学技術の専門誌の新製品の欄に1頁を使って、写真入りで |
|
〇物性推算法 |
|
本サイトの運営者はIHI㈱に入社後、直ちに物性推算の実務に、従事し、現場体験をもとに「物性推算法」(主要著書10番)を上梓した。同書は、実務体験をもとに、実務に従事する化学技術者を対象をとしている。そのために、類書である、"The Properties of Gases and Liquids"では取り扱われていない気液平衡推算式の温度特性などの記述や、純物質の蒸気圧推算法が記載されていて、広く国内や台湾・中国の科学技術者に使われている。同書の発行以後、「物性推算法」なる語が定着した感がある。 |
|
2. 本サイトの運営者・大江修造が関係した国家プロジェクト |
|
経済産業省の蒸留技術国家プロジェクト2006に審査委員長として参加した。 |
|
3. 本サイトの運営者・大江修造の主要受賞歴 |
|
〇文部科学大臣表彰 科学技術賞(平成17年度) |
|
4. 本サイトの運営者・大江修造の主要著書 |
|
(1)"Computer Aided Data Book of Vapor-liquid Equilibria", Elsevier, (共著), |
|
5. 本サイトの運営者・大江修造による主要データベース・ソフトウェア |
|
(1)Excel蒸気圧データ -アントワン式定数集ー |